Contenidos
¿Qué estudia la química?
La química estudia la composición de todas las materias que se encuentran sobre la Tierra.
Explica de qué elementos están constituidos, cuáles son sus afinidades y cómo es posible modificar sus composiciones y propiedades para transformarlos en materiales utilizables por la industria o en productos comercializables.
Los teóricos de la quimica no se preguntan para que servirá lo que descubran, aunque, en general, facilitan el que se haga uso práctico de ello.

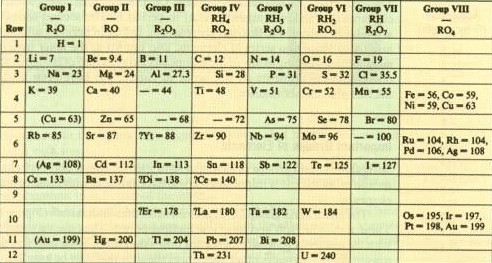
Dmitri Mendeléyev, químico ruso nacido en 1834 y fallecido en 1907.
Su más importante descubrimiento fue el «sistema periódico» de los elementos químicos, que dio lugar a la llamada «tabla de Mendeleief».
Gracias a este sistema, pudo prever, antes de su descubrimiento, la existencia de otros componentes.
La química se ha convertido en las sociedades industrializadas en eslabón imprescindible para su funcionamiento, y está presente en todas sus actividades.
¿Qué son las moleculas?
Unos de los mayores descubrimientos de la química fue que toda materia está formada por minúsculas particulas llamadas «moleculas». Durante mucho tiempo se creyó que eran las partes más pequeñas en las que se podía dividir la materia.
Si tomamos un bote de sal de cocina, diremos, por ejemplo, que contiene innumerables moléculas de sal y que cada una de éstas posee la misma dimensión y propiedades que las demás.

Albert Einstein nació en Ulm (Alemania) en 1879 y, en 1934, se exilió a los Estados Unidos, donde murió en 1955.
En 1905, recibió el título de doctor.
Se le considera como a uno los genios del campo de la física matemática.
Su fama proviene especialmente de su «teoría de la relatividad», que, todavía hoy, no es completamente comprendida más que por un restringido círculo de sabios.
Era judio, razón por la que no pudo proseguir sus trabajos en Berlín.
En 1921, sus investigaciones fueron recompensadas con el Premio Nobel de Fisica.
Cuando no existe ninguna molécula de otra clase mezclada con ellas, podemos decir que se trata de «sal pura».
Pero, con el tiempo, se llegó a descubrir que era absolutamente imposible la obtención de una materia completamente pura.
Se ha demostrado, sin embargo, en el estudio de ciertos fenómenos, que, en casos muy particulares, tenía gran importancia la impureza de las materias.
En el estudio de los abonos químicos es donde mejor se ha observado la importancia de tantas «impurezas».
Una vez conocida la molécula, se pasó a preguntarse si no existia en los cuerpos químicos una parte menor que aquélla, Esto dio lugar a la teoría del átomo.
La molécula tiene importancia como unidad de medida en las reacciones químicas.
Tabla periódica de los elementos
Tabla periódica de los elementos para imprimir en PDF e imagen
Estado de los elementos en condiciones normales de presión y temperatura (0 °C y 1 atm).
Gases
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Hidrógeno | H | 1 | 1 | 1 | 1 | 1 | 0 | 1 |
| Nitrógeno | N | 15 | 2 | 7 | 14 | 7 | 7 | 7 |
| Oxígeno | O | 16 | 2 | 8 | 16 | 8 | 8 | 8 |
| Flúor | F | 17 | 2 | 9 | 19 | 9 | 10 | 9 |
| Cloro | Cl | 17 | 3 | 17 | 35 | 17 | 19 | 17 |
| Helio | He | 18 | 1 | 2 | 4 | 2 | 2 | 2 |
| Neón | Ne | 18 | 2 | 10 | 20 | 10 | 10 | 10 |
| Argón | Ar | 18 | 3 | 18 | 40 | 18 | 22 | 18 |
| Kriptón | Kr | 18 | 4 | 36 | 84 | 36 | 48 | 36 |
| Xenón | Xe | 18 | 5 | 54 | 131 | 54 | 77 | 54 |
| Radón | Rn | 18 | 6 | 86 | 222 | 86 | 136 | 86 |
Líquidos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Cesio | Cs | 1 | 6 | 55 | 133 | 55 | 78 | 55 |
| Francio | Fr | 1 | 7 | 87 | 223 | 87 | 136 | 87 |
| Mercurio | Hg | 12 | 6 | 80 | 201 | 80 | 121 | 80 |
| Galio | Ga | 13 | 4 | 31 | 70 | 31 | 39 | 31 |
| Bromo | Br | 17 | 4 | 35 | 80 | 35 | 45 | 35 |
Elementos de transición
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Rutherfordio | Rf | 4 | 7 | 104 | 261 | 104 | 157 | 104 |
| Dubnio | Db | 5 | 7 | 105 | 262 | 105 | 157 | 105 |
| Seaborgio | Sg | 6 | 7 | 106 | 263 | 106 | 157 | 106 |
| Tecnecio | Tc | 7 | 5 | 43 | 99 | 43 | 56 | 43 |
| Bohrio | Bh | 7 | 7 | 107 | 262 | 107 | 155 | 107 |
| Hassio | Hs | 8 | 7 | 108 | 265 | 108 | 157 | 108 |
| Meitnerio | Mt | 9 | 7 | 109 | 266 | 109 | 157 | 109 |
| Darmstadtio | Ds | 10 | 7 | 110 | 271 | 110 | 161 | 110 |
| Roentgenio | Rg | 11 | 7 | 111 | 272 | 111 | 161 | 111 |
| Copernicio | Cn | 12 | 7 | 112 | 272 | 112 | 160 | 112 |
| Nihonio | Nh | 13 | 7 | 113 | 283 | 113 | 170 | 113 |
| Flerovio | Fl | 14 | 7 | 114 | 285 | 114 | 171 | 114 |
| Moscovio | Mc | 15 | 7 | 115 | 288 | 115 | 173 | 115 |
| Livermorio | Lv | 16 | 7 | 116 | 289 | 116 | 173 | 116 |
| Teneso | Ts | 17 | 7 | 117 | 291 | 117 | 174 | 117 |
| Oganesón | Og | 18 | 7 | 118 | 293 | 118 | 175 | 118 |
Elementos lantánidos y actínidos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Prometio | Pm | Lantánido | (-) | 61 | 147 | 61 | 86 | 61 |
| Neptunio | Np | Actínido | (-) | 93 | 237 | 93 | 144 | 93 |
| Plutonio | Pu | Actínido | (-) | 94 | 244 | 94 | 150 | 94 |
| Americio | Am | Actínido | (-) | 95 | 243 | 95 | 148 | 95 |
| Curio | Cm | Actínido | (-) | 96 | 247 | 96 | 151 | 96 |
| Berkelio | Bk | Actínido | (-) | 97 | 247 | 97 | 150 | 97 |
| Californio | Cf | Actínido | (-) | 98 | 251 | 98 | 153 | 98 |
| Einstenio | Es | Actínido | (-) | 99 | 252 | 99 | 153 | 99 |
| Fermio | Fm | Actínido | (-) | 100 | 257 | 100 | 157 | 100 |
| Mendelevio | Md | Actínido | (-) | 101 | 258 | 101 | 157 | 101 |
| Nobelio | No | Actínido | (-) | 102 | 259 | 102 | 157 | 102 |
| Laurencio | Lr | Actínido | (-) | 103 | 262 | 103 | 159 | 103 |
Sólidos alcalinos y alcalinotérreos
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Litio | Li | Alcalino | 2 | 3 | 7 | 3 | 4 | 3 |
| Sodio | Na | Alcalino | 3 | 11 | 23 | 11 | 12 | 11 |
| Potasio | K | Alcalino | 4 | 19 | 39 | 19 | 20 | 19 |
| Rubidio | Rb | Alcalino | 5 | 37 | 86 | 37 | 49 | 37 |
| Berilio | Be | Alcalinotérreo | 2 | 4 | 9 | 4 | 5 | 4 |
| Magnesio | Mg | Alcalinotérreo | 3 | 12 | 24 | 12 | 12 | 12 |
| Calcio | Ca | Alcalinotérreo | 4 | 20 | 40 | 20 | 20 | 20 |
| Estroncio | Sr | Alcalinotérreo | 5 | 38 | 88 | 38 | 50 | 38 |
| Bario | Ba | Alcalinotérreo | 6 | 56 | 137 | 56 | 81 | 56 |
| Radio | Ra | Alcalinotérreo | 7 | 88 | 226 | 88 | 138 | 88 |
Sólidos de las familias del escandio, titanio, vanadio y cobre
| Elemento | Símbolo | Grupo | Período | Átomo | Masa | Protones | Neutrones | Electrones |
|---|---|---|---|---|---|---|---|---|
| Escandio | Sc | Escandio | 4 | 21 | 45 | 21 | 24 | 21 |
| Itrio | Y | Escandio | 5 | 39 | 89 | 39 | 50 | 39 |
| Lantano | La | Escandio | 6 | 57 | 139 | 57 | 82 | 57 |
| Actinio | Ac | Escandio | 7 | 89 | 227 | 89 | 138 | 89 |
| Titanio | Ti | Titanio | 4 | 22 | 48 | 22 | 26 | 22 |
| Circonio | Zr | Titanio | 5 | 40 | 91 | 40 | 51 | 40 |
| Hafnio | Hf | Titanio | 6 | 72 | 179 | 72 | 105 | 72 |
| Vanadio | V | Vanadio | 4 | 23 | 50 | 23 | 27 | 23 |
| Niobio | Nb | Vanadio | 5 | 41 | 93 | 41 | 52 | 41 |
| Tantalio | Ta | Vanadio | 6 | 73 | 181 | 73 | 108 | 73 |
| Cobre | Cu | Cobre | 4 | 29 | 64 | 29 | 35 | 29 |
| Plata | Ag | Cobre | 5 | 47 | 107 | 47 | 61 | 47 |
| Oro | Au | Cobre | 6 | 79 | 196 | 79 | 118 | 79 |
¿En qué consiste la teoría del átomo?
La teoría atómica pretende que toda molécula se encuentra dividida en partículas, todavía menores, que reciben el nombre de «átomos» (esta palabra procede del griego y significa «inseparable»).
En virtud de ello, la molécula de sal contiene dos átomos.
Más tarde, veremos que los hay de diferentes clases y que éstas presentan subdivisiones.
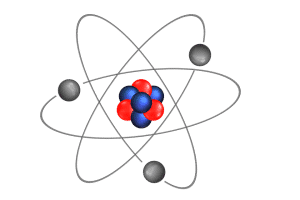
Representación esquemática del átomo.
Constituye la partícula más pequeña de un elemento químico.
La palabra átomo quiere decir «que no se puede separar».
Posteriormente, se descubrió que estaban formados por protones, electrones y neutrones.
Los primeros constituyen el núcleo positivo, alrededor del que giran los electrones, de signo negativo.
¿Como es un átomo?
La palabra átomo quiere decir «que no se puede separar», pero esta palabra no es apropiada ya que el átomo está constituido por minúsculas partículas.
Es difícil representarse su mundo y composición, aunque podamos imaginarnoslo como un sistema solar en miniatura
en el que unos diminutos planetas giran alrededor de un sol un poco mayor, aunque también resulta invisible a nuestros ojos.
Este sol es el núcleo que se encuentra en el centro del átomo y está formado por uno o más protones y de cero a varios neutrones. Los protones están cargados positivamente, mientras que los neutrones no están cargados. En conjunto, reciben el nombre de «nucIeones».
Además y en función del numero de protones, unas partículas cargadas de electricidad negativa gravita alrededor del núcleo: los electrones.
Podemos imaginamos las diversas posibiIidades de enlace entre los átomos y, yendo todavía más lejos, hablar de la escisión.
Al examinar detenidamente ciertostipos de átomos, se llegó a la conclusión de que emiten ondas e incluso unas rapidísimas partículas. Posteriormente, se comprobó que era muy peligroso trabajar con estos cuerpos, aunque era de capital importanciaiproseguir las investigaciones
por su interés para la Medicina, abriendo con ello un camino esperanzador en el tratamiento de enfermedades‘ de difícil curación.
¿Cuál es la diferencia entre química orgánica e inorgánica?
Hace tiempo, se explicaba aproximadamente así: los enlaces orgánicos son de carbono, mientras que los inorgánicos, con pocas excepciones, no incluyen átomos de carbono en su composición.
Esta distinción provenía del hecho de que se establecía una diferencia entre los cuerpos quimicos que forman los seres vivos y los demás, como el agua, gas, aire, piedra, tierra, etc.
Tras el descubrimiento de los materiales sintéticos, la explicación de “esta distinción se ha hecho mucho más delicada.
¿Qué son, efectivamente, las materias sintéticas sino un conjunto del elementos que, a su vez, constituyen organismos vivos?
En la actualidad, existen miles de materias orgánicas que no tienen nada que ver con esta diferenciación entre materia viva y materia muerta.

El caucho natural procede de la resina del árbol del mismo nombre, originario de América del Sur.
Más tarde, durante la época de las colonias, fue transplantado a las lndias holandesas y a Indonesia.
El látex -otro nombre que recibe el cauchoposee una consistencia lechosa, endureciéndose más tarde gracias a un proceso quimico de calentamiento a base de azufre. Durante la Segunda Guerra Mundial, los paises beligerantes sufrieron la falta de caucho, por lo que la industria química tuvo que ponerse en movimiento y, a través de sus investigaciones, llegar a descubrir el caucho artificial.
No tenemos más que pensar en los plásticos que tan de moda se pusieron antes de que comenzaremos a darnos cuenta de sus numerosos inconvenientes.
Hay quienes pretenden, con o sin ironia, que el mundo perecerá invadido por residuos plásticos prácticamente indestructibles.

Durante y después de la Segunda Guerra Mundial, se iniciaron numerosas investigaciones sobre la composición de las macromoléculas, como el poliéster.
Así se llegaron a fabricar hilos, fibras, discos e incluso películas a base de esta materia.
Muchas prendas de vestir contienen un gran porcentaje de estas fibras sintéticas que, en muchos casos, poseen propiedades superiores a las de los hilos y fibras de algodón y lana.
En la fotografía, podemos ver tela de poliester actual.